Link to original video by Klonusk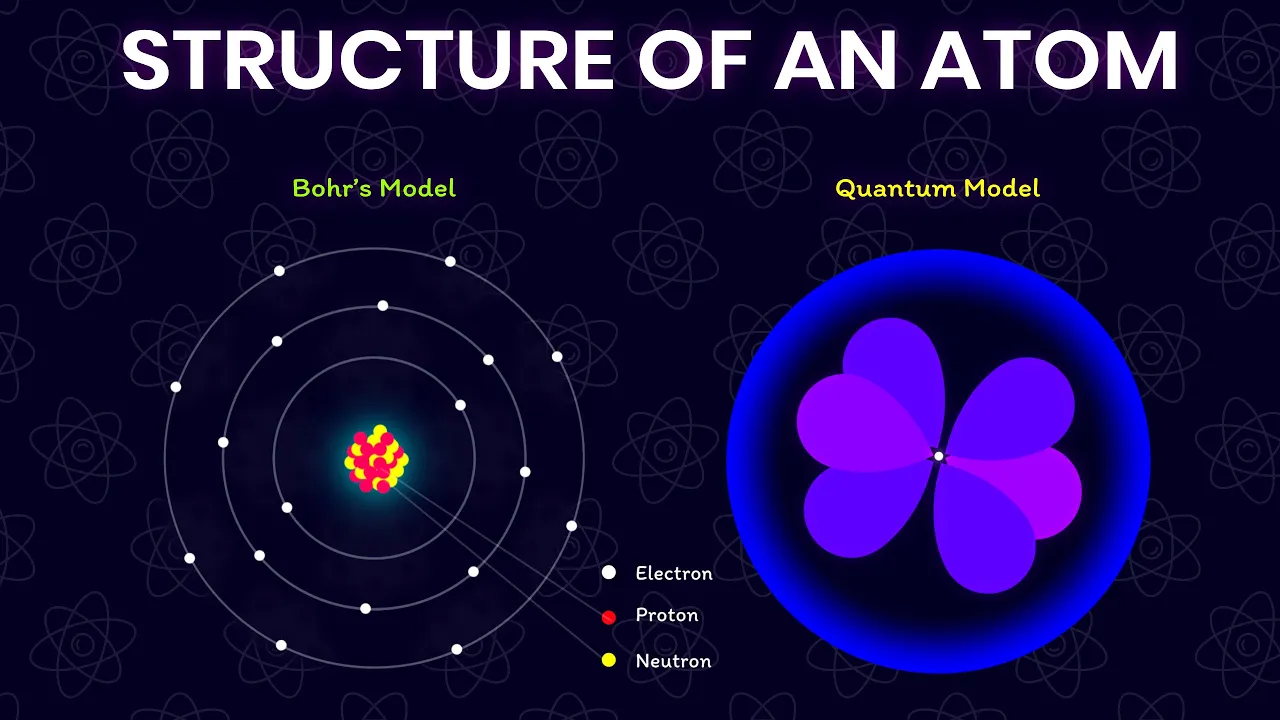
A Brief History Of Atom | Democritus to Quantum | Atomic Models

Tóm tắt video "Lịch sử ngắn gọn về nguyên tử | Từ Democritus đến Lượng tử | Các mô hình nguyên tử"
Tóm tắt ngắn gọn:
- Video giới thiệu lịch sử nghiên cứu về nguyên tử, từ những suy đoán triết học cổ đại đến các mô hình nguyên tử hiện đại.
- Các điểm chính được thảo luận bao gồm: mô hình nguyên tử của Democritus, Dalton, Thomson, Rutherford, Bohr và mô hình lượng tử.
- Video cũng đề cập đến các khái niệm quan trọng như: sự bảo toàn khối lượng, tỷ lệ xác định, tia cathode, hạt alpha, mô hình hành tinh, nguyên lý bất định Heisenberg và tính chất sóng-hạt của vật chất.
- Video giải thích chi tiết về các mô hình nguyên tử khác nhau, bao gồm cả cách chúng được phát triển và những hạn chế của chúng.
Tóm tắt chi tiết:
Phần 1: Suy đoán cổ đại về nguyên tử
- Video bắt đầu bằng việc giới thiệu ý tưởng về nguyên tử của nhà triết học Hy Lạp Democritus, người cho rằng vật chất có thể được chia nhỏ đến một mức độ nhất định, sau đó sẽ đạt đến những hạt nhỏ nhất không thể chia nhỏ được, gọi là "atomos".
- Video cũng đề cập đến ý tưởng tương tự của nhà triết học Ấn Độ Archarya Kanad, người gọi những hạt nhỏ nhất này là "anu".
- Tuy nhiên, những ý tưởng này chỉ là suy đoán và chưa có bằng chứng khoa học để chứng minh.
Phần 2: Lý thuyết nguyên tử của Dalton
- Năm 1808, nhà giáo dục người Anh John Dalton đưa ra lý thuyết nguyên tử đầu tiên dựa trên cơ sở khoa học.
- Dalton cho rằng mọi vật chất đều được tạo thành từ những nguyên tử, những hạt nhỏ nhất, không thể chia nhỏ được và có hình dạng cầu.
- Ông cũng khẳng định rằng tất cả các nguyên tử của một nguyên tố đều giống nhau về kích thước, khối lượng và tính chất.
- Dalton giải thích được định luật bảo toàn khối lượng và định luật tỷ lệ xác định dựa trên lý thuyết nguyên tử của mình.
Phần 3: Khám phá electron và mô hình nguyên tử của Thomson
- Từ những năm 1850, các nhà khoa học bắt đầu nghiên cứu tia cathode, một loại tia phát ra từ cực âm của một ống phóng điện.
- Năm 1897, nhà vật lý người Anh J.J. Thomson phát hiện ra rằng tia cathode thực chất là dòng các hạt mang điện tích âm, được gọi là electron.
- Thomson đề xuất mô hình nguyên tử "bánh pudding" với các electron được nhúng trong một "biển" điện tích dương.
Phần 4: Mô hình nguyên tử của Rutherford
- Năm 1911, nhà vật lý người New Zealand Ernest Rutherford thực hiện thí nghiệm tán xạ hạt alpha trên lá vàng.
- Kết quả thí nghiệm cho thấy hầu hết các hạt alpha đi xuyên qua lá vàng, một số bị lệch hướng và một số rất ít bị phản xạ trở lại.
- Rutherford kết luận rằng nguyên tử có cấu trúc rỗng, với phần lớn khối lượng tập trung vào một vùng nhỏ gọi là hạt nhân, mang điện tích dương, và các electron quay xung quanh hạt nhân.
Phần 5: Mô hình nguyên tử của Bohr
- Mô hình nguyên tử của Rutherford không thể giải thích được sự ổn định của nguyên tử.
- Năm 1913, nhà vật lý người Đan Mạch Niels Bohr đưa ra mô hình nguyên tử mới, dựa trên các tiên đề sau:
- Electron chỉ có thể tồn tại ở những mức năng lượng xác định, gọi là quỹ đạo hoặc lớp vỏ.
- Electron không phát ra năng lượng khi chuyển động trên quỹ đạo.
- Electron có thể hấp thụ hoặc phát ra năng lượng khi chuyển từ quỹ đạo này sang quỹ đạo khác.
- Bohr giải thích được phổ vạch phát xạ của nguyên tử hydro và đưa ra công thức tính bán kính quỹ đạo và năng lượng của electron.
Phần 6: Khám phá proton và neutron
- Năm 1917, Rutherford phát hiện ra proton, hạt mang điện tích dương trong hạt nhân.
- Năm 1932, nhà vật lý người Anh James Chadwick phát hiện ra neutron, hạt không mang điện trong hạt nhân.
Phần 7: Mô hình lượng tử của nguyên tử
- Mô hình nguyên tử của Bohr không thể giải thích được tính chất sóng-hạt của vật chất và nguyên lý bất định Heisenberg.
- Năm 1924, nhà vật lý người Pháp Louis de Broglie đề xuất rằng mọi vật chất đều có tính chất sóng-hạt.
- Năm 1927, nhà vật lý người Đức Werner Heisenberg đưa ra nguyên lý bất định, khẳng định rằng không thể xác định chính xác vị trí và vận tốc của một hạt cùng một lúc.
- Mô hình lượng tử của nguyên tử được phát triển bởi Werner Heisenberg và Erwin Schrödinger vào năm 1926.
- Mô hình lượng tử cho rằng electron không quay quanh hạt nhân theo quỹ đạo xác định, mà tồn tại dưới dạng đám mây electron, với xác suất tìm thấy electron cao hơn ở những vùng nhất định.
Kết luận:
- Video kết thúc bằng cách khẳng định rằng mô hình lượng tử là mô hình nguyên tử hiện đại nhất, giải thích được nhiều hiện tượng liên quan đến nguyên tử hơn các mô hình trước đó.
- Video nhấn mạnh rằng mô hình lượng tử dựa trên các khái niệm phức tạp về cơ học lượng tử, nhưng nó đã giúp chúng ta hiểu rõ hơn về cấu trúc và tính chất của nguyên tử.